¿Estas buscando información acerca de las reacciones espontaneas y no espontaneas? Entonces estas en el sitio correcto. te invito a descubrir TODO acerca de este tema,
¡Bienvenido!
Una reacción química es un proceso que lleva a la transformación de un conjunto de sustancias químicas a otro. Las reacciones químicas pueden ser espontáneas, sin necesidad de aporte de energía, o no espontánea, a menudo se origina después de la entrada de algún tipo de energía, a saber.
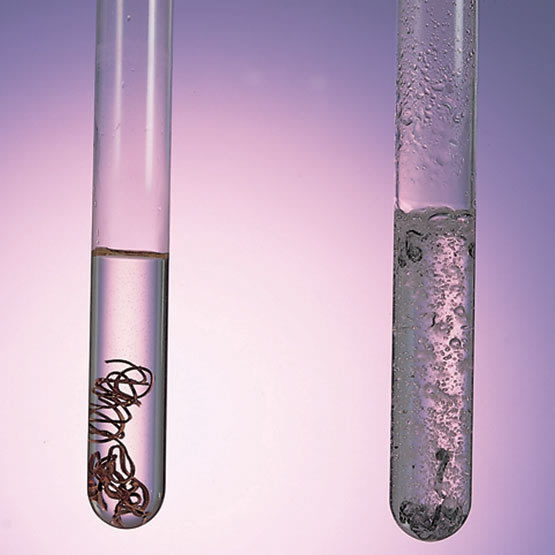
La reacción no espontánea es una reacción química en donde el incremento de energía libre es positivo. Bajo condiciones de temperatura y presión constantes, esto quiere decir que el incremento en la energía libre de Gibbs estándar debe ser positivo Constante de equilibrio Las reacciones no espontáneas se manifiestan durante los procesos anabólicos; de manera que, requieren que se le añade energía a los reactivos, se le suma energía, Las reacciones no espontáneas se llevan a cabo con la energía liberada por las reacciones exergónicas. Las reacciones exergónicas pueden estar acopladas con reacciones no espontáneas. La constante de equilibrio de la reacción esta relacionado a ΔG° por la relación: donde T es la temperatura absoluta y R es el la constante de los gases ideales. Un valor positivo de ΔG° entonces implica de modo que a partir de las cantidades de estequiometricas una reacción se moverían hacia la izquierda del equilibrio y no a la derecha. Sin embargo, las reacciones no espontáneas son bastante frecuentes en la naturaleza, especialmente en la bioquímica y fisiología. Algunos ejemplos de reacciones no espontánea en células incluye la síntesis de proteínas, y el bombeo de Na /K que produce la conducción nerviosa y la contracción muscular. Esto es debido a que la reacciones no espontáneas están asociadas a reacciones espontáneas de forma que el incremento de energía libre total si que es negativo Considerando ambas reacciones globalmente.
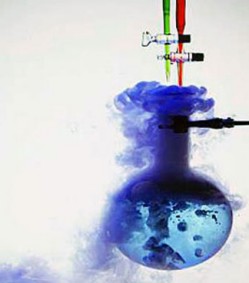 Reacción espontanea: es, en termodinámica, la
evolución en el tiempo de un sistema en el cual se libera energía
libre, usualmente en forma de calor, hasta alcanzar un estado energético
más estable. La convención de signos en los cambios de la energía libre sigue
la convención general para medidas termodinámicas, en la cual una liberación de
energía libre desde el sistema corresponde a un cambio negativo en la energía
libre, pero un cambio positivo para los alrededores.
Reacción espontanea: es, en termodinámica, la
evolución en el tiempo de un sistema en el cual se libera energía
libre, usualmente en forma de calor, hasta alcanzar un estado energético
más estable. La convención de signos en los cambios de la energía libre sigue
la convención general para medidas termodinámicas, en la cual una liberación de
energía libre desde el sistema corresponde a un cambio negativo en la energía
libre, pero un cambio positivo para los alrededores.
Un proceso espontáneo es capaz de proceder en una dirección
dada, tal como se escribe o es descrita, sin necesidad de que dicho acto sea
realizado por una fuente exterior de energía. El término es usado para
referirse a procesos macroscópicos en los cuales la entropía se
incrementa; tal como la difusión de una fragancia en un cuarto, la fusión de
hielo en agua tibia, la disolución de sal en agua, o la oxidación del hierro.
Las leyes de la termodinámica gobiernan la
dirección de un proceso espontáneo, asegurando que si un número suficientemente
grande de interacciones individuales (como átomos colisionando) están
involucrados, entonces la dirección del proceso siempre estará en la dirección
del incremento de entropía (debido a que el incremento de la entropía es
un fenómeno estadístico).
¡HEY! SI AUN NO ENTENDISTE, VEAMOS LO DE UNA FORMA MAS SIMPLE:
una reacción es espontanea cuando el simple
contacto de los reactivos desencadena la reacción sin ningún otro requisito.
una reacción no espontanea es cuando requiere
de aporte energetico (generalmente) continuo o presencia de enzimas (catalizadores) específicos para que la reacción tenga lugar.
Bueno si tienes alguna duda acerca de estos dos tipos de reacciones espero tu comentario, ¡hasta la próxima lectores!
LESLIE SAN FRANCISCO LUNA.
COLEGIO SANTA FAMILIA
PROFESOR DIXON ARDILES
QUÍMICA
3°MEDIO C




No hay comentarios:
Publicar un comentario